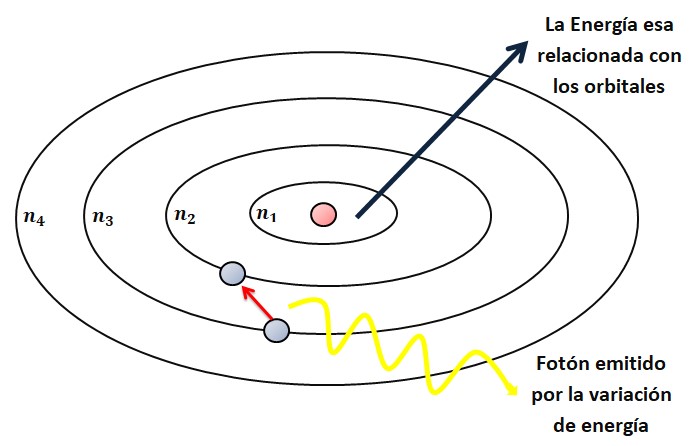
Un átomo de Rydberg es un átomo excitado con uno o varios electrones en estados con un número cuántico principal alto.[1][2] Estos átomos tienen propiedades bastante particulares, entre las que se encuentran una respuesta exagerada a campos eléctricos y magnéticos,[3] tiempos de decaimiento largos y funciones de onda electrónicas que se aproximan (bajo ciertas condiciones) a las órbitas clásicas de los electrones alrededor del núcleo.[4] Estos electrones externos perciben un potencial similar al potencial eléctrico dado por un átomo de hidrógeno, pues los electrones internos apantallan a los electrones de valencia del campo eléctrico creado por el núcleo.[5]
A pesar de sus deficiencias, el modelo atómico de Bohr es útil para explicar estas propiedades. Desde el punto de vista clásico, un electrón en una órbita circular de radio r alrededor de un núcleo de hidrógeno de carga e, obedece la segunda ley de Newton:
donde k = 1/(4πε0).
El momento orbital se encuentra cuantizado en unidades de ħ:
Combinando estas dos ecuaciones llegamos a la expresión de Bohr para el radio orbital en función del número principal cuántico, n:
Partiendo de esta ecuación uno puede comprender por qué los átomos de Rydberg muestran propiedades tan particulares: el radio orbital escala como n2 (el estado con n = 137 de hidrógeno tiene un radio orbital ~1 µm), y la sección efectiva geométrica crece como n4. Así pues, los átomos de Rydberg son extremadamente grandes y sus electrones de valencia, ligados débilmente al núcleo, son perturbados fácilmente o incluso ionizados por colisiones o campos externos.
Dado que la energía de ligadura de un electrón en un estado de Rydberg es proporcional a 1/r, y por lo tanto disminuye como 1/n2, el espaciado energético entre niveles adyacentes disminuye como 1/n3, lo que da lugar a niveles cada vez más cercanos que convergen a la primera energía de ionización. Estos estados tan cercanos forman lo que se conoce como la serie de Rydberg.
Véase también
- Johannes Rydberg
- Fórmula de Rydberg
- Teoría cuántica antigua
Referencias
![]()